FDA首次批准对纤溶酶原缺乏症患者的治疗
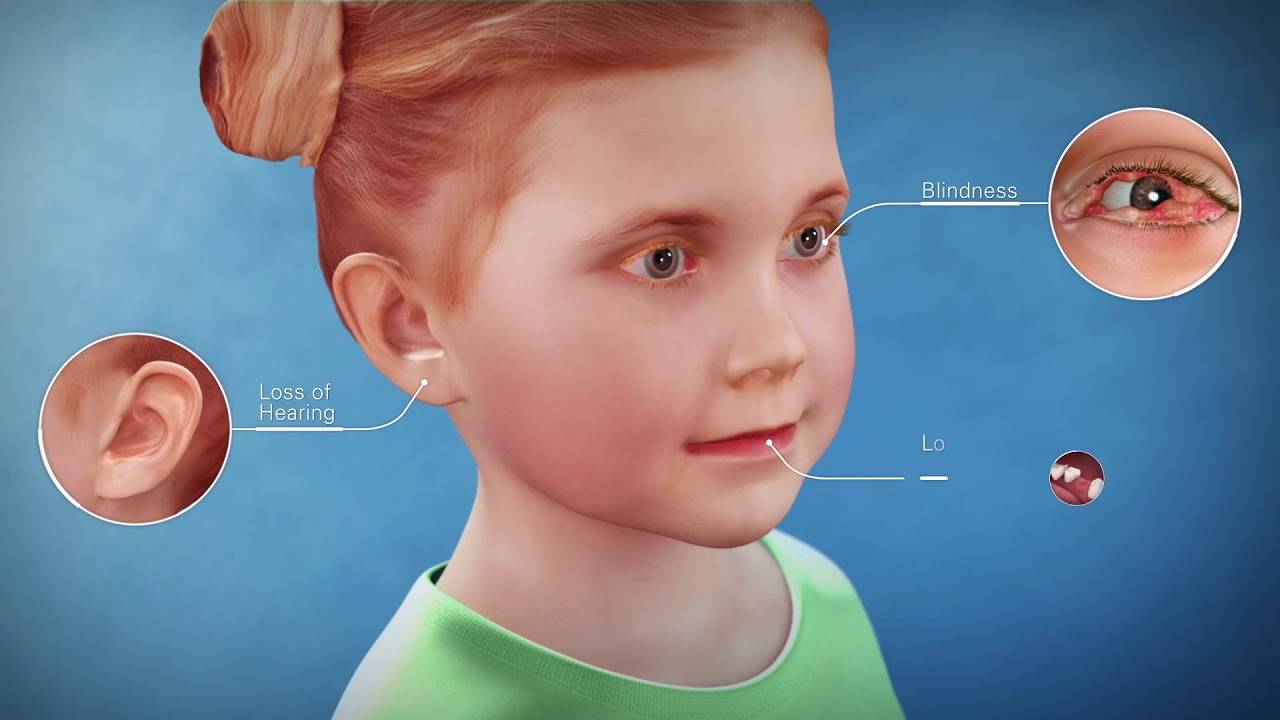 今天,美国食品和药物管理局批准 Ryplazim(纤溶酶原,human-tvmh)用于治疗1型纤溶酶原缺乏症患者,也称为低纤溶酶原血症,一种可损害正常组织和器官功能并可能导致失明的疾病。
今天,美国食品和药物管理局批准 Ryplazim(纤溶酶原,human-tvmh)用于治疗1型纤溶酶原缺乏症患者,也称为低纤溶酶原血症,一种可损害正常组织和器官功能并可能导致失明的疾病。
FDA 生物制品评估和研究中心主任、医学博士说,“ 今天的批准有助于解决受这种罕见遗传疾病影响的个人未满足的医疗需求。”
患有这种疾病的人缺乏一种叫做纤溶酶原的蛋白质,它负责身体分解纤维蛋白凝块的能力。纤溶酶原缺乏会导致纤维蛋白积聚,导致生长(病变)的发展,从而损害正常组织和器官的功能,当这些病变影响眼睛时,可能会导致失明。
Ryplazim 中的活性成分是从人血浆中纯化的纤溶酶原。用 Ryplazim 治疗有助于提高血浆纤溶酶原水平,能够暂时纠正纤溶酶原缺乏症并减少或消除病变。
Ryplazim的有效性和安全性主要基于一项单臂、该试验招募了15名患有1型纤溶酶原缺乏症的成人和儿童患者。所有患者每2至4天接受一次 Ryplazim 给药,持续48周。
Ryplazim的有效性通过所有11名基线时有病灶的患者的病灶改善至少50%,以及在48周的治疗中15名患者中的任何一个都没有复发或新病灶出现。
接受 Ryplazim 治疗的患者报告的最常见副作用:包括腹痛、腹胀、恶心、出血、四肢疼痛、疲劳、便秘、口干、头痛、头晕、关节痛和背痛。
FDA授予Ryplazim孤儿药称号,为协助和鼓励罕见病药物开发提供激励措施。该申请还获得了快速通道指定、优先审查和罕见的儿科疾病优先审查凭证。
https://www.fda.gov/news-events/press-announcements/fda-approves-first-treatment-patients-plasminogen-deficiency-rare-genetic-disorder

全球顶级医生协会(Global Top Doctors Association)是美国加州政府正式注册的联邦政府批准的一个非营利性,非宗教,非政治性国际社会组织,总部位于洛杉矶。全球顶级医生协会为中西方医学和精神专业人士的科学研究创造更有利的环境,为他们提供机会在社区,全国以及全球服务人群,满足民众的身体与精神健康需求。
小提示:87%用户已下载掌上医讯App,更方便阅读和交流,请扫描二维码直接下载App

(本网站所有内容,凡注明来源为“掌上医讯”,版权均归掌上医讯所有,欢迎转载,转载请注明出处,否则将追究法律责任。凡是本网站注明来源为其他媒体的内容为转载,版权归原作者所有,转载仅作分享,文章观点不作为掌上医讯观点,如有侵权,请及时联系我们,联系电话:0532-67773733)

