吴小材:当常规新辅助的胃癌患者正好是dMMR时
临床决策分析
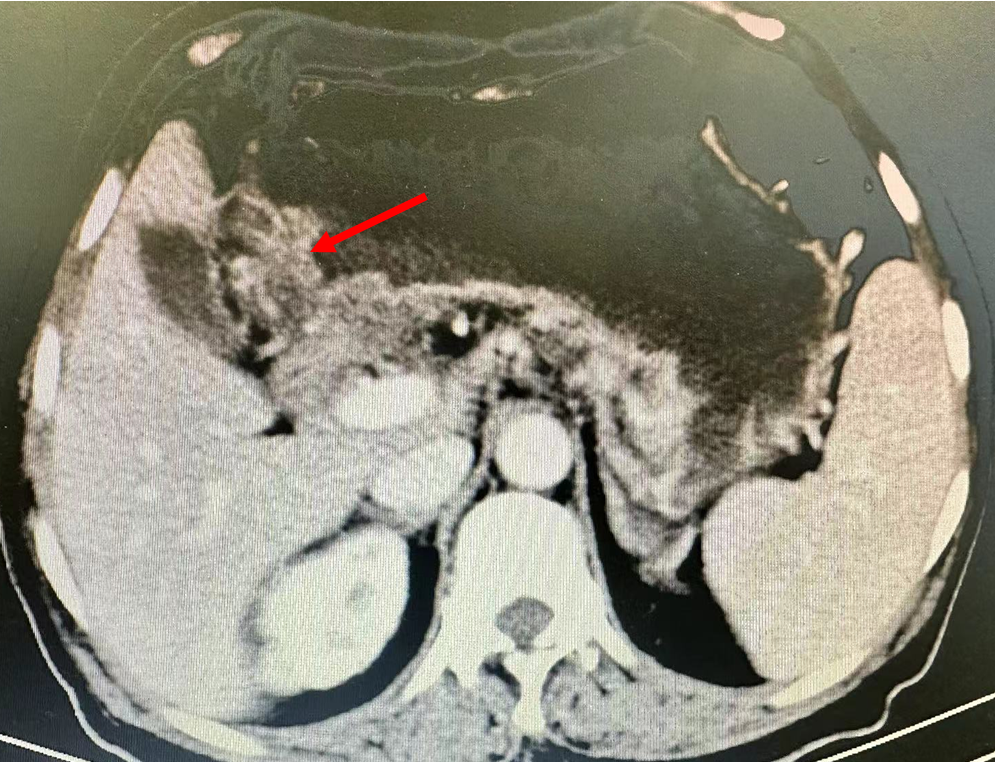
术前胃CT图,箭头指示胃窦增厚
手术规划
患者取大字位,在脐下1cm做1.0cm小切口,气腹针穿刺成功接CO2气腹,置入10mmTrocar,放入腹腔镜探查:腹腔内未见明显腹水,肝脏左外叶与胃体小弯部分紧密粘连,予以分离后取粘连组织送快速病理检查(胃壁组织) 局灶见少量异型腺体,组织挤压变形且烧灼伤明显,最终性质待石蜡报告。盆腔表面未见明显种植转移灶。再分别于左、右侧腹直肌旁,左侧锁骨中线外侧肋缘下分别做5mm及12mm小切口置入Trocar。先将胃体小弯侧与左肝粘连处分离,并切除部分肝组织。
用超声刀打开胃小网膜囊前页至肝十二指肠韧带。提起胃结肠韧带沿横结肠向右侧分离,显露十二指肠外侧。分离胃网膜右血管,见6组淋巴结肿大,于胃右血管根部用可吸收夹夹闭后切断,清扫第6组淋巴结。于胰头前方分离,剥离肝总及肝固有血管分叉处,清扫第5组,第12组淋巴结。进一步松解十二指肠第一、二段周围间隙。继续使用超声刀将胃结肠韧带自横结肠中部沿结肠表面向左侧切开,切断大弯侧血供,分离胃网膜左血管,Hem-o-lock夹毕胃网膜左血管,松解脾胃韧带,将大网膜从脾包膜表面剥离,同时清扫第4组淋巴结。显露胃小弯侧,切开隔肌角,剥离第1、3组淋巴结,将胃体上翻,显露后方。沿胰腺上缘切开胰包膜,同时清扫第11P组淋巴结,暴露胃胰皱襞,分离胃左血管,于胃左血管根部用Hem-o-lock夹毕,清扫第7,8,9组淋巴结。用美外60ENDOGI切割缝合器于距幽门管以远4cm处切断十二指肠。
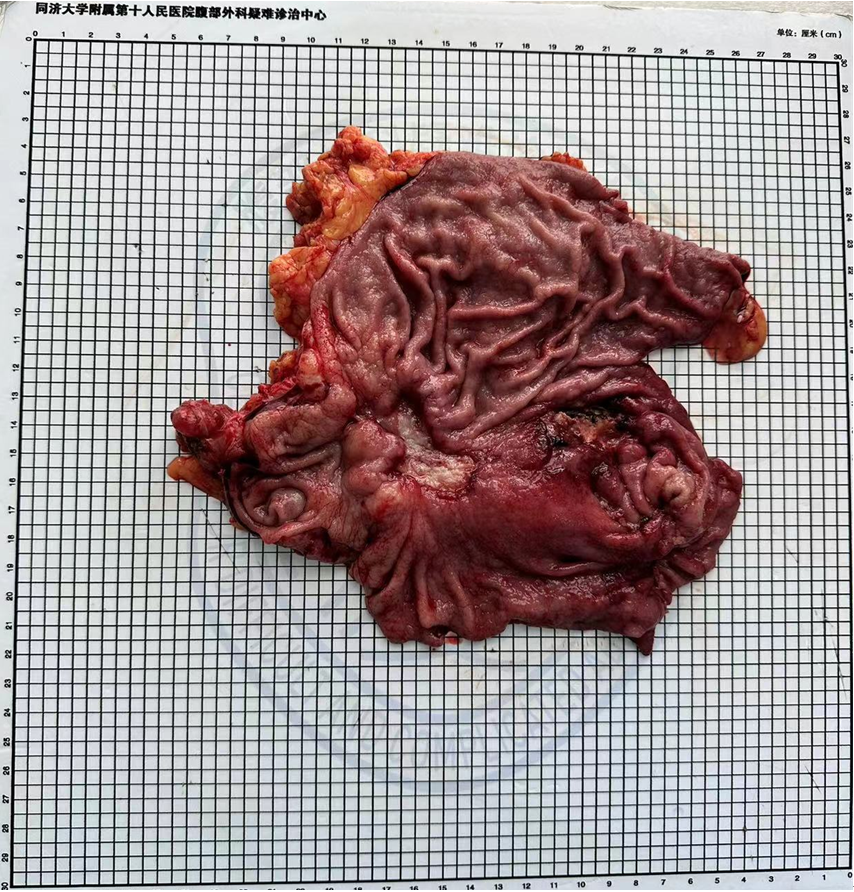
脐上腹正中线高频电刀取切口长约8m开腹。于屈氏韧带下方20cm处空肠切开置入美外28管型吻合器底钉座,荷包缝合结扎。探查肿块位于胃体部,胃体距肿瘤6cm处,用endo-GIA紫钉8切割关闭器关闭胃腔,取出肿瘤。再用美外吻合杆做空肠与胃后壁做侧侧吻合,用直线切割闭合器关闭胃残端。可吸收线加固吻合口及胃壁残端。可吸收线加固缝合十二指肠残端。将胃管置入毕II吻合输入袢。术后巨检见胃窦肿瘤直径约3cm。
预后及随访
患者术后病理提示:
黏液腺癌,浸润至肌层外纤维脂肪组织。肿瘤细胞部分退变,间质纤维增生伴组织细胞反应,符合治疗后改变。脉管瘤栓(-)。上切端、下切端均未见癌累及。小弯侧淋巴结10枚、大弯侧淋巴结5枚未见癌转移,个别淋巴结呈治疗后改变。
黏膜大片溃疡形成,伴部分胃壁全层急、慢性炎细胞浸润,灶区可见肝组织。备注: 病史提示该病例为治疗后,部分结果供参考。免疫组化结果: d片 肿瘤细胞ae1/3(),ema(+),cea(+),p53(少+),c-erbb2(0),syn(-),cga(-),mlh1(-),msh2(+),nsh6(+),pms2(-), cd34(血管+),ki-67(80%+),原位杂交eber(-)。FISH检测:HER-2阴性。
这个患者经过术前新辅助化疗联合免疫治疗,获得了较好的缩瘤效果,虽然新辅助治疗之前并未进行进一步的基因检测或者错配修复基因的免疫组化检测,但这个人幸运的是属于免疫治疗适应症人群(dMMR)。在患者体力评分允许的情况下,预计后期继续辅助免疫治疗+辅助化疗,再后来应予免疫治疗维持。当然也可以推荐患者进一步行基因检测,第二代的NGS结果有助于在辅助治疗前提供免疫治疗的进一步依据。
目前新辅助免疫治疗虽然2022年就写进了结直肠癌的NCCN指南,但新辅助免疫治疗在胃癌领域仍未有定论。目前已有非常多的新辅助免疫治疗的临床试验正在进行当中。我们团队也对部分Ⅳ期胃癌患者(包括多发肝转移、腹膜转移、淋巴结转移及盆腔转移病例)进行了新辅助免疫治疗联合标准新辅助化疗的转化治疗方案,我们发现,即时不是MSI-H或dMMR患者,耐受全程新辅助治疗的患者,其转化降期效果较好,部分患者甚至经过全程新辅助治疗后得到完全缓解,在等待观察期间生活质量较高。这些新辅助的胃癌患者里头,均有以下其中一项:TMB高,PDL-1评分高。
近年来液体活检越来越多被运用于实体肿瘤。对于这个患者的情形,最新NCCN指南亦推荐在术后监测中引入液体活检,血液之中的循环肿瘤DNA检测具有取标本方便,可重复进行多次,可再很长的一段时间内多次检测等优点,部分阳性检测结果可能对治疗反应有提示意义,为调整治疗方案提供指导。
本文仅供医疗行业专业人士学习使用
参考文献:
[1]. Le DT, Uram JN, Wang H, et al. PD-1 blockade in tumors with mismatch-repair deficiency. N Engl J Med 2015;372:2509-2520.
[2]. Bartley AN, Fitzgibbons PL, Broaddus RR, Shi C. Template for Reporting Results of DNA Mismatch Repair Testing in Patients Being Considered for Checkpoint Inhibitor Immunotherapy. College of American Pathologists. 2018.
[3]. Kato S, Okamura R, Baumgartner JM, et al. Analysis of circulating tumor DNA and clinical correlates in patients with esophageal, gastroesophageal junction, and gastric adenocarcinoma. Clin Cancer Res 2018;24:6248-6256.
[4] Willis J, Lefterova MI, Artyomenko A, et al. Validation of microsatellite instability detection using a comprehensive plasma-based genotyping panel. Clin Cancer Res 2019;25:7035-7045
本文作者
小提示:87%用户已下载掌上医讯App,更方便阅读和交流,请扫描二维码直接下载App

(本网站所有内容,凡注明来源为“掌上医讯”,版权均归掌上医讯所有,欢迎转载,转载请注明出处,否则将追究法律责任。凡是本网站注明来源为其他媒体的内容为转载,版权归原作者所有,转载仅作分享,文章观点不作为掌上医讯观点,如有侵权,请及时联系我们,联系电话:0532-67773733)