中低位直肠癌侧方淋巴结转移影像学的诊断价值





回顾性分析通过腹盆部增强CT和(或)盆腔MRI发现侧方淋巴结可疑阳性的共计79例直肠癌患者,并记录其最大的淋巴结短径及病理是否为阳性。纳入标准:①从2010年1月至2019年12月就诊于北京大学第一医院普通外科行直肠癌根治术联合单侧或双侧方淋巴结清扫术的患者;②术前行结直肠镜检查,病理诊断为直肠腺癌的患者;③直肠肿瘤中心位于腹膜反折以下;④肿瘤下缘距肛缘≤10 cm;⑤术前行腹盆部CT或盆腔MRI的患者。排除标准:①年老不能耐受手术的患者;②重要临床资料(病理)不完整的患者。

本组患者均行全直肠系膜切除术(TME),远端切除边缘>1 cm。切除直肠系膜后,将髂总动脉周围、髂内、髂外区及闭孔窝周围脂肪结缔组织外侧淋巴结清扫,使髂血管骨骼化,保留自主神经。

①根据术前影像学发现肿大淋巴结区域与术后病理进行对应;②同一病例发现多个淋巴结阳性转移则视为单独淋巴结纳入研究;③侧方淋巴结影像检查最大短径等数据需由1名高年资影像科医师和1名外科医师共同测量完成;④肿瘤学资料参照AJCC结直肠癌TNM分期(2019年第8版)。

使用IBM SPSS Statistics 23统计软件进行数据分析。根据淋巴结最大短径与病理关系绘制ROC曲线和柱状分布图并找出截断值,计算在该截断值时的灵敏度、特异度。符合正态分布的计量资料以x̅±s表示。单因素分析中,分类变量的比较采用Pearson χ²检验或Fisher精确概率法。采用Logistic 回归分析侧方淋巴结转移阳性的独立危险因素。P<0.05为差异有统计学意义。
结果

本组79例患者中男49例,女30例,平均年龄为(55.2±11.1)岁,肿瘤距肛门平均距离为(5.8±2.7)cm,均位于腹膜反折以下。手术均遵循TME的原则,其中43%(34例)患者行直肠前切除术及直肠括约肌间切除术,33%(26例)患者行腹会阴联合直肠癌根治术,2%(2例)患者行Hartmann术,22%(17例)患者行全盆腔脏器切除术。68%(54例)患者行单侧侧方淋巴结清扫,32%(25例)患者行双侧侧方淋巴结清扫。71%(56例)患者肿瘤呈高中分化,29%(23例)患者肿瘤分化较差,包括13%(10例)呈低分化、11%(9例)呈黏液腺癌、5%(4例)呈印戒细胞癌。根据AJCC结直肠TNM分期,16%(13例)患者T分期呈1~2期,84%(66例)患者T分期呈3~4期;25%(20例)患者TNM分期呈Ⅰ~Ⅱ期,75%(59例)患者TNM分期Ⅲ~Ⅳ期。

通过病理检查,48%(38/79)的患者侧方淋巴结转移呈现阳性;79例患者手术共清扫侧方淋巴结466枚,17%(78枚)清扫淋巴结转移呈现阳性,平均每例患者清扫的侧方淋巴结数目为(5.9±5.2)枚。

结合术前影像学检查,转移阳性淋巴结的平均大小和中位数大小分别为(11.4±6.3)mm和9 mm(4~31 mm),阴性淋巴结的平均大小和中位数大小分别为(5.7±2.4)mm和6 mm(2~40 mm),组织病理学证实的转移阳性淋巴结直径大于阴性淋巴结(P=0.000 1)。根据术前影像学检查共发现112枚直肠侧方淋巴结,淋巴结最大短径在0~5mm之间,88%转移阴性,12%转移阳性;淋巴结最大短径在6~10 mm之间,35%转移阴性,65%转移阳性;淋巴结最大短径在11~15 mm之间,100%转移阳性;淋巴结最大短径在16~20 mm之间,88%转移阴性,12%转移阳性;淋巴结最大短径>20 mm的侧方淋巴结100%转移阳性。大淋巴结(>20 mm)与较高的转移率相关,直径<5 mm的淋巴结很少发生转移。

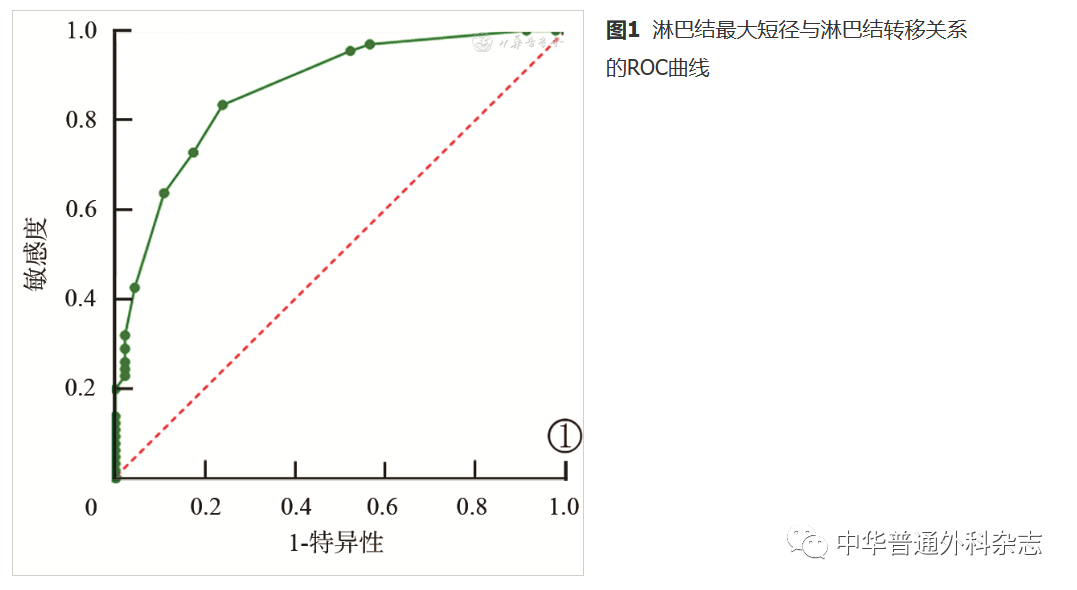
根据112枚淋巴结最大短径与转移阳性率的关系绘制ROC曲线,计算曲线下面积为0.867,分析准确性较高(图1)。根据ROC曲线计算出7 mm为临界值。根据该临界值,计算敏感性、特异性、阳性预测值、阴性预测值分别为83.3%、76.1%、83.3%、76.1%。

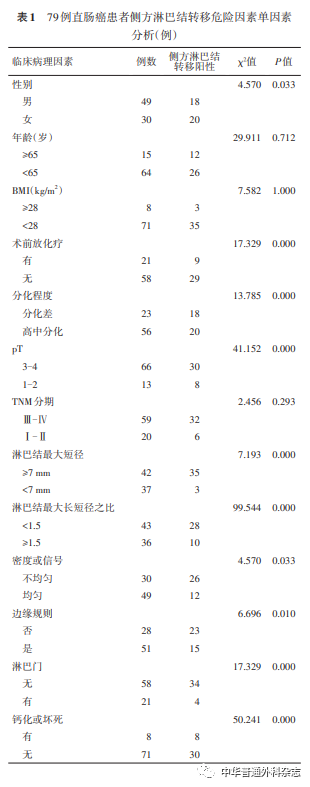
单因素分析结果显示,患者年龄、BMI、肿瘤TNM分期与中低位直肠癌侧方淋巴结转移均无关(均P<0.05),性别、行术前放化疗、T分期、淋巴结最大短径≥7 mm、淋巴结最大长短径之比、密度或信号不均匀、边缘不规则、无淋巴门、发现钙化或坏死均与侧方淋巴结转移有关(均P<0.05)(表1)。
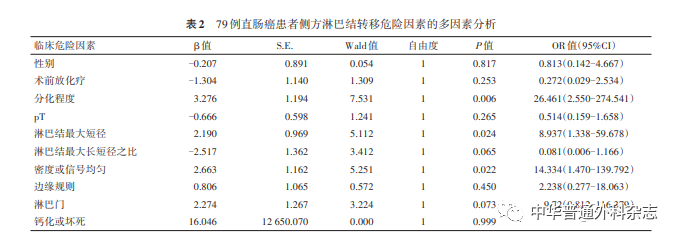
将上述因素纳入Logistic回归分析结果发现,肿瘤分化差(包括低分化、黏液腺癌、印戒细胞癌)、侧方淋巴结最大短径≥7 mm、密度或信号不均匀是侧方淋巴结转移的独立危险因素(均P<0.05)(表2)。
讨论
术前影像学检查包括腹盆部增强CT、盆腔MRI及PET/CT等成为鉴别直肠癌侧方淋巴结转移的重要手段。西方国家主张针对中低位直肠癌侧方淋巴结转移或可疑转移的患者行新辅助放化疗联合TME[1],但患者仍在治疗后出现侧方局部区域复发。在以日本为主的亚洲国家,越来越多的循证医学证据表明,TME联合侧方淋巴结清扫术可以降低局部复发率[2]。同时,侧方淋巴结最大短径是预测预后的重要因素。Yamaoka等[3]回顾性研究显示,侧方淋巴结最大短轴直径≥7 mm的患者,中低位直肠癌侧方型复发率明显增高(19.5%比4.9%)。日本多项研究推荐将短径10 mm确定为侧方淋巴结转移的临床诊断标准,但侧方淋巴结转移的诊断目前尚无统一的标准。
在本研究中,接受手术的低位直肠癌患者中有48%存在侧方淋巴结转移。然而,侧方淋巴结转移并不常见。通常直肠淋巴通过直肠上淋巴结回流,而中低位直肠增加了侧方淋巴结的回流途径。1955年,Sauer等基于对肿瘤位置的探讨,并利用色素法研究直肠癌的淋巴引流、淋巴结转移状况,提出距肛门7 cm以下的直肠淋巴引流方向大部分向上,少部分为侧方淋巴引流和经直肠中动脉周围的淋巴管流入髂内动脉周围淋巴结。目前,临床上侧方淋巴结清扫中的区域淋巴结主要包括腹主动脉分叉、髂总、髂外动脉周围淋巴结(第280、273、293组);闭孔内淋巴结(第283组);髂内动脉周围淋巴结(第263组):膀胱上动脉分叉部的中枢侧第263P组,末梢侧第263D组三部分[4]。据报道,低位直肠癌患者的侧方淋巴结转移发生率为16%~23%。本研究中38例患者有侧方淋巴结转移,另外41例患者没有发生侧方淋巴结转移,但接受了不必要的扩大淋巴结清扫术,增加了手术与术后并发症发生风险,因此术前准确预测包括侧方淋巴结受累在内的分期在确定最佳治疗策略方面起着重要作用。
腹盆部增强CT可以发现在增强期直肠周围及侧方区域强化的淋巴结,而盆腔MRI根据较大的淋巴结短径或存在混合信号强度或不规则的淋巴结包膜边界来诊断[5]。不论是腹盆部增强CT或是盆腔MRI,在中低位直肠癌淋巴结转移的诊断标准中仍然存在争议。本研究通过本中心79例患者的数据,寻找术前影像学检查包括CT、MRI在中低位直肠癌侧方淋巴结转移的诊断标准,以提高影像学诊断准确度,降低手术及术后并发症风险,为患者带来更多获益。近10年由于术前影像检查富集于可疑侧方淋巴结转移病例,侧方淋巴结清扫阳性率显著升高。笔者经历了由过去双侧方清扫到针对性单侧方清扫的转变[6]。同时,由于侧方淋巴结位置较深,进入盆腔后操作空间不足,手术清扫侧方淋巴结难度较大,平均每例患者清扫侧方淋巴结(5.9±5.2)枚。Ishibe等[7]研究表明,该中心平均每例患者清扫侧方淋巴结(13.6±6.4)枚,而总侧方淋巴结转移阳性率不高。
西方国家认为因侧方淋巴结与髂内外血管、泌尿生殖神经关系密切,扩大淋巴结清扫范围可能会造成损伤,因此新辅助放化疗依然是西方国家治疗直肠癌侧方淋巴结转移的金标准。西方同样进行研究评估影像学对侧方淋巴结转移的诊断准确性。Lambregts等[8]报道MRI对直肠癌淋巴结分期的敏感性和特异性分别为71%和63%。Mizukami等[9]报道MRI预测病理结节受累的敏感性和特异性分别为52%和77%。本研究结果显示,腹盆部增强CT[和(或)盆腔增强MRI]对中低位直肠癌侧方淋巴结转移诊断的敏感性、特异性分别为85%和83%,与上述研究结果相近。
研究每例患者的术前影像学检查发现,在同一侧方区域或不同区域常出现多枚肿大的淋巴结,形态不规则,或融合成团,因此在绘制ROC曲线时采用79例患者共计112枚淋巴结的最大短径数据,并以此来确定截断值为7 mm。Akiyoshi等[10]研究结果显示,直肠癌侧方淋巴结转移术前影像对于最大短径的截断值为8 mm,与本研究结果相近。本研究发现,在16~20 mm范围的淋巴结中有11%为阴性,考虑该现象出现可能的原因是炎性反应导致侧方淋巴结的增大。低位直肠处于消化道末端,受环境影响较大,在肿瘤患者中自然杀伤细胞、巨噬细胞等多种免疫细胞参与炎症反应,从而导致直肠周围淋巴结反应性增生,在CT或MRI中表现为肿大的淋巴结,仅凭侧方淋巴结最大短径来诊断证据并不充分,故在研究中挖掘影像中其他参数,发现结合淋巴结长短径之比、淋巴结信号或密度、淋巴结边缘是否规则、淋巴门结构是否存在、淋巴结是否有钙化或坏死等因素可能会提高对于侧方淋巴结转移阳性的诊断准确度。Oh等[11]研究发现新辅助放化疗后侧方淋巴结的缩小是预测侧方淋巴结转移的独立危险因素。
组织病理学证实,肿瘤呈低分化、黏液腺癌、印戒细胞癌将预示着侧方淋巴结转移的风险增高。影像学数据中,侧方淋巴结最大短径≥7 mm、密度或信号不均匀是中低位直肠癌侧方淋巴结转移的独立危险因素。Kim等[12]研究发现,57例患者中40.4%发生侧方淋巴结转移,新辅助放化疗之前淋巴结最大短径≥8 mm、接受术前放化疗后侧方淋巴结缩小33.3%、异质性与侧方淋巴结转移有关。
本研究有以下不足。因侧方淋巴结转移发生率不高,研究纳入本中心10年来行侧方淋巴结清扫的病例79例,样本量小。对于侧方淋巴结转移的中低位直肠癌患者,建议接受新辅助放化疗后通过再次影像学评估效果之后行手术治疗。本中心27%(21/79)的患者接受术前放化疗,由于缺少新辅助放化疗前后影像学资料,难以评估新辅助放化疗对于侧方淋巴结的影响。

小提示:87%用户已下载掌上医讯App,更方便阅读和交流,请扫描二维码直接下载App

(本网站所有内容,凡注明来源为“掌上医讯”,版权均归掌上医讯所有,欢迎转载,转载请注明出处,否则将追究法律责任。凡是本网站注明来源为其他媒体的内容为转载,版权归原作者所有,转载仅作分享,文章观点不作为掌上医讯观点,如有侵权,请及时联系我们,联系电话:0532-67773733)

