【专家笔谈】纤维-骨肿瘤及结构不良的临床病理特征与鉴别诊断
点击“中华口腔医学杂志”快速关注本刊官微
作者:史册 李志民 孙宏晨
通信作者:孙宏晨
作者单位:吉林大学口腔医院病理科(史册、孙宏晨);中国医科大学口腔医学院·附属口腔医院医学影像科 辽宁省口腔疾病重点实验室(李志民)
引用本文:史册, 李志民, 孙宏晨. 纤维-骨肿瘤及结构不良的临床病理特征与鉴别诊断[J]. 中华口腔医学杂志, 2023, 58(2): 124-130. DOI: 10.3760/cma.j.cn112144-20220905-00477.
纤维-骨病变是在临床表现和病理学特征上有明显相似性的一类疾病,一直受到临床医师以及病理医师的关注。2022年WHO第5版头颈部肿瘤的最新分类将其中牙骨质-骨结构不良、节段性牙上颌结构不良、纤维结构不良、青少年小梁状骨化纤维瘤、沙瘤样骨化纤维瘤和家族性巨大型牙骨质瘤等6种疾病列入“纤维-骨肿瘤及结构不良”,并对这些疾病的诊断和治疗提出了新的观点。本文根据2022年WHO最新分类,对这6种疾病的临床病理特征、诊断和鉴别诊断进行阐述,以期为临床诊疗提供参考。
纤维-骨病变(fibro-osseous lesion)并非一个特异性诊断名词,而是以富含细胞的纤维结缔组织替代正常骨组织为特征,病变中含有数量不等、形态不一的灶状钙化组织的一组病变。这些疾病虽然表现形式和程度不同,但在临床和病理学特征上有明显相似性,存在分类及诊断困难。
2022年WHO第5版头颈部肿瘤的最新分类将牙骨质-骨结构不良(cemento-osseous dysplasia,COD)、节段性牙上颌结构不良(segmental odontomaxillary dysplasia,SOD)、纤维结构不良(fibrous dysplasia,FD)、青少年小梁状骨化纤维瘤(juvenile trabecular ossifying fibroma,JTOF)、沙瘤样骨化纤维瘤(psammomatoid ossifying fibroma,PsOF)和家族性巨大型牙骨质瘤(familial gigantiform cementoma,FGC)等6种疾病合称为纤维-骨肿瘤及结构不良(fibro-osseous tumours and dysplasias)[1]。本文针对这些疾病的临床病理特征和鉴别诊断进行阐述,以期为临床鉴别诊断提供一定帮助。
1.COD:COD是一组发生于颌骨承牙部位根尖周区域的以纤维组织和化生性骨取代正常骨组织的特发性疾病。COD的病因尚未完全明确,Nel等[2]认为COD可能是由牙槽骨对局部因素的异常反应引起的。在2005年WHO分类中将“牙骨质-骨结构不良(cemento-osseous dysplasia)”改为“骨结构不良(osseous dysplasia)”,但在2022年WHO新分类中又将其恢复为“牙骨质-骨结构不良”,承认它们为牙源性、起源于牙周韧带[3]。
根据解剖位置和颌骨累及程度,COD分为3种明确的亚型:根尖周COD(periapical COD,PCOD)、局灶性COD(focal COD,FocCOD)和繁茂性COD(florid COD,FCOD)。2022年WHO新分类又引入COD的第4种亚型:家族性FCOD(familial FCOD,FFCOD)[1]。
COD好发于中年女性[4],尤其是非洲人及非裔美国人。COD通常无症状,病变处颌骨膨隆不明显,病变范围内的牙齿多为活髓,但也有部分患者表现出炎症相关症状,如疼痛、肿胀、脓性分泌物和触诊压痛等[5]。早期X线影像可为圆形或椭圆形、界限清晰的透光区,与牙周韧带相连续;中期可表现为透射、阻射混合影像或薄层透射影包绕不透光区;随着病变进展,可表现为阻射影像[6]。
肉眼观COD病变为大小不等的砂砾状骨。光镜下可见纤维结缔组织间质中间穿插着编织状、片状骨和嗜碱性牙骨质样钙化岛,周围少见成骨细胞;随着病程进展,钙化成分增多,反转线明显,血管成分减少,最终可形成硬化性肿块。
多数COD为非肿瘤性,并且具有自限性,无须手术干预[7]。但若病灶过大或炎症明显则应手术治疗并定期随访。
(1)PCOD:PCOD为发生于下颌骨前部、切牙根尖区的单发或多发性病损,受累牙仍有活力。随着病变部位矿化增加,病变阻射影也增加,但PCOD具有一定自限性,病变直径一般不超过1 cm[8]。PCOD可根据影像学特征加以诊断而较少进行活检。PCOD在中年非洲黑人女性中普遍存在,提示其可能有遗传易感性[9]。
(2)FocCOD:FocCOD为发生于颌骨后牙区的单一病损[10]。有系统综述显示,FocCOD可能与拔牙部位有关,这也一定程度上支持了该病是对损伤或创伤的异常骨反应这一病因猜测[3]。FocCOD好发于下颌骨,多见于女性。除非洲人外,非裔美国人和亚洲人也是明显易患该病的人群[9]。部分病例可发生囊性变及颌骨膨隆[11]。
根据影像学特点,FocCOD病变可分为早、中、晚期3个阶段,早期病变表现为下颌牙根尖部界限清楚的放射透光区;中期表现为放射性透光区与放射性阻射区混合影,或在阻射区周围有界限清楚的透射环(图1A);晚期表现为弥散性放射性阻射影,通常边界不清。光镜下可见粗大曲线形骨小梁或不规则形牙骨质样团块,周围少见成骨细胞。
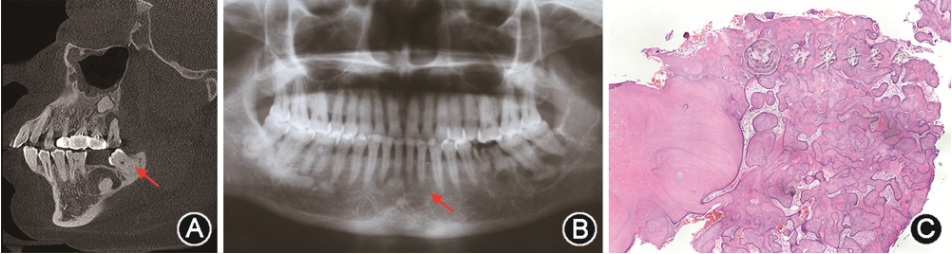
图1 牙骨质-骨结构不良(COD)的影像学和病理学表现 A:局灶性COD的CT片显示阻射区周围有界限清楚的透射环(箭头示);B:繁茂性COD的曲面体层X线片显示累及下颌骨双侧的透射阻射混合影(箭头示);C:繁茂性COD的病理学表现显示不规则骨样团块(HE染色 低倍放大)
(3)FCOD:FCOD可累及颌骨两个及以上象限[12],大部分病例累及下颌骨双侧、累及或不累及上颌骨,常在下颌骨磨牙或前磨牙区。患者发病年龄多为47~49岁,黑人女性较多见[8]。FCOD通常无症状,呈对称性分布,部分病例可发生囊性变及颌骨膨隆[11]。FCOD的X线及病理特征与FocCOD相似(图1B,C)。当X线表现为不规则或多房性放射性透光区时,类似于单纯性骨囊肿,但无囊肿的上皮衬里。
(4)FFCOD:FFCOD的临床表现与FCOD类似,但具有明显家族史。Lv等[13]对1个中国患者家系的全外显子组进行了测序分析,结果显示氯离子通道anoctamin 5(简称ANO5)中的一种新型错义突变p.C356W为致病突变(即蛋白质参考序列中第356位的半胱氨酸C被色氨酸W取代)。FFCOD发病早于FCOD,且较少显示出明显的种族或性别倾向性[11],4个象限的颌骨均可能广泛受累,易引起局部颌骨膨隆,可伴炎症或创伤性溃疡形成,常影响牙齿萌出并有乳牙滞留[11]。
FFCOD的X线表现也与FCOD类似,包括早期的透光区、过渡到中期的透射-阻射混合病变以及最终的硬化性不透光病变。相邻病灶可能融合形成更大的硬化区。光镜下可见病变由致密的少细胞硬化区和坏死骨形成,骨髓腔内可见密集纤维化,并散在牙骨质样钙化小球[2]。
2.SOD:SOD为一种发生在上颌骨内节段性的罕见骨病变,不具有遗传性,以单侧上颌骨和软组织增生为特征,可见牙齿异常,偶有同侧皮肤改变[14]。SOD的病因尚未明确,某些病例病变组织的组织基因组DNA分析结果显示有体细胞PIK3CA或ACTB突变[15],但具体机制还有待研究。
病变局限于单侧上颌骨,但无明显侧别倾向,表现为上颌无痛性增生,通常累及前磨牙、磨牙及相关牙槽骨,甚至可压迫上颌窦。上颌增生为非进行性的,一般从儿童期开始到青春期[16],常见牙龈纤维性增生。该病多伴有牙齿异常,如乳牙滞留、先天缺牙、牙釉质和牙本质结构异常和牙形态异常等。可有轻微面部表现,如多毛症、皮肤色素沉着(如Becker痣)和面部红斑等[17, 18]。X线显示正常骨小梁被特征性垂直向不透光条纹所取代,似“雨夹雪”样外观,界限不清。
病理检查结果显示,SOD病变处牙龈呈纤维性增生,偶见钙化;骨组织可见编织状和板层状不规则骨小梁,少量破骨细胞,可见明显反转线[17],纤维成分为不成熟的胶原蛋白,与其他良性纤维-骨病变不同的是间质中细胞较少;有时牙体组织可见牙根外吸收、牙本质结构异常和牙髓纤维性变。
SOD在青春期前进展缓慢,若病灶过大、影响美观功能时可能需要手术切除[1]。
3. FD:FD是一种罕见的良性骨病变,由G蛋白α亚基(Gs-α)的基因GNAS的体细胞突变引起,常见致病突变为精氨酸201号密码子变为组氨酸或半胱氨酸(R201H或R201C),导致腺苷酸环化酶的激活,作用于下游信号使cAMP水平升高,进而致正常骨被纤维组织和编织骨替代[19, 20]。尽管GNAS基因的致病作用较为明确,但近年有研究表明,在与NEK9突变相关的粉刺样黑痣综合征中发现了FD[21]。
根据发病部位不同,FD可分为单骨型(累及单个骨)、多骨型(累及多个骨)和颅颌面型(累及颅颌面多处相邻骨且过中线)。伴有内分泌功能亢进和皮肤色素沉着时为McCune-Albright综合征[22]。单骨型最多见[23],占80%~85%,无明显性别差异,多骨型则多发于女性,多见于儿童及青年。颅面骨最易患病,上颌骨及鼻腔的发病率高于下颌骨[9]。患者一般无明显症状,为无痛性缓慢骨膨隆。发生在颌面部可导致颜面部不对称,牙齿结构及萌出正常,但随着颌骨膨隆变形可发生牙移位。发生于上颌的FD可引起鼻塞和慢性鼻窦炎,发生于颅底者可能压迫神经,进而影响视觉和听觉[24]。X线显示早期病变为透射影,阻射影逐渐增加,特征性影像学表现为病变部位呈毛玻璃样改变(图2A),或者混合性放射阻射影,与周围组织界限不清[24]。
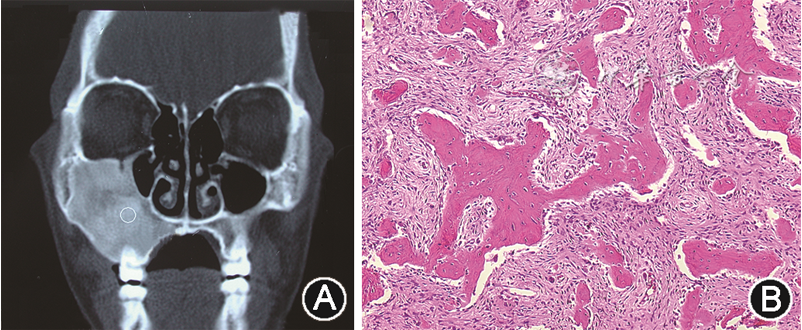
图2 纤维结构不良的影像学及病理学表现 A:冠状面CT,显示病灶部位呈毛玻璃样改变;B:病理学表现显示编织状骨小梁结构(HE染色 低倍放大)
光镜下见正常骨组织被排列疏松的纤维组织所取代,形成形态不规则的编织状骨小梁(图2B),这些幼稚骨小梁通常互不相连,呈英文字母“C”“S”和“V”状,周围无成排的成骨细胞,但骨表面可见破骨细胞。纤维组织中成纤维细胞呈梭形,无异型性。颌骨FD在成熟过程中可见成骨细胞和板层骨结构。病变中可能有软骨形成,但在颌骨FD中较少见。
FD是良性病变,成年患者病变生长减缓,因此治疗的重点是预防各种并发症(如视觉、听觉受损)及尽量减少畸形、疼痛和病理性骨折。临床上常采用手术和药物治疗两种方式。手术方式高度个性化,在病变范围大且症状明显时才行扩大切除并即刻修复[25]。药物治疗多采用双膦酸盐类药物,且低磷血症的严重程度可能被用于评估骨骼病变程度[26]。FD预后一般良好,部分FD有肉瘤变的危险性[27],而服用双膦酸盐的 FD 患者发生药物相关性颌骨坏死的风险升高,应加强关注。
4. JTOF:2022年WHO第5版头颈部肿瘤的最新分类将JTOF、PsOF与牙骨质-骨化纤维瘤(cemento-ossifying fibroma,COsF)分开,JTOF和PsOF作为两个独立的疾病类型列入“纤维-骨肿瘤及结构不良”,而COsF则属于良性间叶性牙源性肿瘤(benign mesenchymal odontogenic tumours)。
JTOF是一种无包膜的肿瘤,伴有富于细胞的间质和含细胞的带状类骨质。目前研究认为其可能与MDM2和RASAL1基因扩增有关[28]。
JTOF主要发生于颌骨,上下颌骨间的发病率差异无统计学意义;患者常为儿童期发病(平均年龄11.3岁),无明显性别差异[3]。疾病进展迅速,常为颌骨无痛性快速膨隆,进而引起牙移位、面部畸形,发生于上颌者可能引起鼻塞和鼻出血。影像学检查见界限清楚的透射影或透射阻射混合影,透射影多为单房,多数病例可见牙齿移位,少数病例也有牙根吸收或继发动脉瘤性骨囊肿[29]。
JTOF病变呈黄白色,剖面可见棕色曲线带(brown curvilinear strands)。光镜下见富含梭形细胞的基质与相互连接的幼稚骨小梁相混合,骨小梁周围可见成排的成骨细胞[30](图3)。新形成的类骨质与周围基质界限不清,但随病程进展可通过中心矿化形成编织状骨小梁。基质内可散在破骨细胞样巨细胞灶。水肿、出血、破骨细胞和假囊性基质变性构成了似花环的带状结构,对应着标本剖面特征性的棕色曲线带[31]。
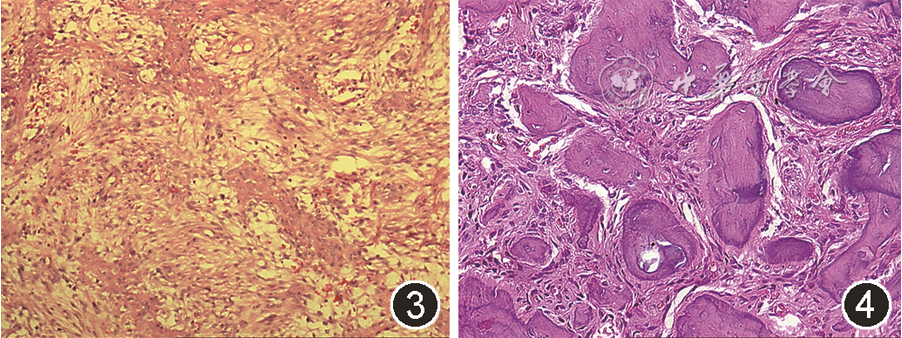
图3 青少年小梁状骨化纤维瘤组织病理学表现(HE染色 低倍放大)
图4 沙瘤样骨化纤维瘤组织病理学表现(HE染色 高倍放大)
约21%的JTOF病例手术后有复发,剜除术加刮除术或扩大切除术可以减少复发风险[29]。JTOF可快速进展,但少见恶变报道。
5. PsOF:PsOF是骨形成组织的真性良性肿瘤。2022年WHO第5版头颈部肿瘤的最新分类将其从COsF中独立出来,并删除原病名中的“青少年”一词。有研究表明,12号染色体上MDM2和RASAL1基因的广泛扩增而非过表达,是PsOF中常见的分子异常,这种异常不仅是一种潜在的分子诊断标记,而且可能提示该病具有更强的侵袭性以及具有更高的复发风险[28]。
PsOF常见于较年轻人群(20~40岁),男性稍多。多发生于颅骨及颌面骨,常见部位是鼻窦、眼眶和额筛复合体。常表现为无其他明显症状的快速骨膨隆,可能伴疼痛,根据发病部位不同还可能有鼻塞、鼻出血、眼球突出和视力障碍等症状[29]。依钙化程度和囊变程度的不同,其影像学表现可为透射影、透射阻射混合影或阻射影,透射影多为单房,可有牙齿移位、颅内扩张。
病变剖面为黄色粗砂状,光镜下见密集的纤维细胞间质间有大量沙砾体,包含多个不规则球形沙砾样嗜碱性小体,呈同心圆模式嵌在成纤维细胞基质中(图4),晚期可相互融合呈块状,但无明显板层结构。沙砾样小体周围可见嗜酸性边缘,但无成排成骨细胞。尽管细胞较多,但有丝分裂不明显,罕见多核巨细胞[4]。
PsOF常采用手术切除,若发生颅内扩散,则需神经外科和经面入路联合切除肿瘤。PsOF复发率为30%~56%,无明显特征,但少见恶变报道[32]。
6. FGC:FGC是一种罕见的常染色体显性遗传病,具体病因尚不明确。病变在儿童期出现,青少年时逐渐膨胀导致面部畸形,发病率无明显性别差异。典型临床表现为进行性、多灶性、累及多象限或上下颌颌骨膨胀性病变。晚期病例中,病变表现为明显的无痛性肿胀和明显的面部畸形。病变局限于颌骨内,可以同时累及两个及以上象限。大多数病变表现为上、下颌骨过中线的膨胀性肿块,影像学检查示透射区,含有絮状钙化。
光镜下可见似成纤维细胞的多细胞间质和成熟的胶原纤维交替分布,无有丝分裂象。病变内可有不规则骨小梁结构和散在分布的大小不一的卵圆形、层片状的沙瘤样钙化[33]。
FGC的手术治疗方式较复杂,较难完全切除,且部分切除常导致复发[34]。尽管该病呈进行性进展,但在后期可能趋于稳定[35]。
1. COD:FocCOD早期影像学表现可能被误诊为根尖周炎,可通过牙髓活力试验进行鉴别诊断,FocCOD受累牙牙髓活力正常。FocCOD中期影像与成牙骨质细胞瘤类似,但后者常有病变与受累牙的牙根融合、牙根吸收及牙齿敏感度降低等表现[36]。FocCOD与COsF的鉴别非常重要,FocCOD是一种良性非肿瘤病变,而COsF是真性肿瘤。FocCOD与根尖(21%)或拔牙位点(71%)密切相关,而大多数COsF(86%)与这两者无关[3]。FocCOD由易碎的沙砾状组织构成,易切除,但不能完全区分于邻近正常骨组织,COsF倾向于与正常骨完全分离[2,7]。在FocCOD中可见粗大曲线形骨小梁或不规则形牙骨质样团块,周围少见成骨细胞;而在COsF中,纤细、孤立的骨小梁周围成骨细胞比较常见。
FFCOD与FGC同为“纤维-骨肿瘤及结构不良”,均有家族史,FGC也在X线下表现为累及下颌多个象限的透射及阻射的混合影像,但在病程早期即表现出相当大的、弥漫性和毁容性的颌骨膨隆;而FFCOD多为局部膨隆,一般不造成明显面部畸形。不过,目前对于这两者的鉴别诊断尚有争议,二者具有相似的临床、影像学及组织学表现,故有观点认为二者为同一疾病的不同阶段[33];但也有人认为FGC具有逐步增大的“肿瘤过程”,应归类为COsF的一种类型[2]。总之,关于FFCOD和FGC这两者的异同,仍有待进一步研究。此外,FFCOD还应与甲状旁腺功能亢进-颌骨肿瘤和颌骨长骨发育不良(gnathodiaphyseal dysplasia,GDD)相鉴别。甲状旁腺功能亢进-颌骨肿瘤除颌骨表现外,还伴有甲状旁腺功能亢进、多发性甲状旁腺腺瘤、肾肿瘤和多发性COsF等相关合并症。GDD与FFCOD具有相似的临床特征,但GDD具有特征性的骨骼脆性表现,即颌骨化脓性骨髓炎和频繁发生的多处长骨骨折,基因测序结果显示ANO5基因中的c. 1067 G>A、p. Cys356Tyr突变为其致病突变,即GDD与FFCOD某些致病基因可能相同,但致病突变不同。
2. SOD:SOD需与FD、区域性牙结构不良(regional odontodysplasia)及神经纤维瘤病相鉴别。FD通常不表现SOD中常见的牙齿缺失等牙齿异常,也没有软组织增生,且SOD中颊舌侧骨和牙龈的增生更为对称。区域性牙结构不良表现为牙釉质和牙本质的严重发育不良,易发生龋病和折断,密度较对侧同名牙低,髓腔宽大,牙根短,根尖孔敞开,呈“鬼影样”表现,多数病变发生于上颌骨前部。S100蛋白免疫组化染色可证明SOD中未见牙、骨或牙龈组织中有明显神经纤维增殖,依此可与神经纤维瘤病相鉴别。
3. FD:当FD与COsF相鉴别时,可从影像、病理、基因三方面进行比较。COsF的X线表现为好发于下颌的边界清晰的混合和不透光病变。病理呈多种钙化结构,特征为嗜碱性环状骨或牙骨质小体样结构,所形成的骨小梁周围可见成排的成骨细胞,Toyosawa等[37]研究表明骨钙蛋白在FD中呈强阳性,而在COsF中呈弱阳性。45%~88% 的 FD 中可检测到GNAS基因突变,此外仅3.6%的FD发生拷贝数改变,而44.8%的COsF发生了拷贝数改变[38]。
此外,FD还需与低级别中心性骨肉瘤(low grade central osteosarcoma)相鉴别。低级别中心性骨肉瘤可能与FD非常相似,但其为恶性肿瘤,呈浸润性生长,肿瘤细胞呈弥散的席纹状排列,肿瘤内可见弯曲状新生骨,且该病在颌骨中较少见[39]。
4. JTOF与PsOF:可根据发病部位、年龄及病理表现鉴别JTOF与PsOF。发病部位方面,额鼻眶筛区PsOF发生率更高;在年龄方面,PsOF在成年人中更常见、年龄分布更广泛、患病年龄较大[(18.9±12)岁],JTOF主要发生于年轻患者[(11.5±6)岁];从病理角度,PsOF内无JTOF特征性的棕色曲线带结构[37]。
此外,COsF中钙化结构常为编织骨和板层骨,周围可见成排的成骨细胞,JTOF中主要为不成熟的骨小梁,周围围绕较大的成骨细胞;而PsOF的钙化结构为特征性的沙砾样小体,周围无成排成骨细胞。
5. FGC:关于FGC与FFCOD的比较,前文已有阐述。FGC还需与FD、巨颌症(cherubism)和JTOF相鉴别。相较于FD,FGC内可见大的类牙骨质样嗜碱性团块。巨颌症在光镜下可见FGC中缺乏的多核巨细胞。FGC与JTOF在组织病理学上均表现为类牙骨质样的砂瘤样变,但肉眼观FGC具有坚硬、不易切割的特征。
目前,针对纤维-骨肿瘤及结构不良的命名和分类尚有争议,一部分原因是某些疾病较罕见,缺少相关病例的综合分析。随着分子诊断等方面技术的进步,对此类疾病的理解将更加深入。在临床诊疗过程中,病理学医师不仅需要根据病理特征进行确定性诊断,还需要参考患者年龄、性别和种族等特征,结合临床、影像学表现,并积极了解有关疾病发病机制的最新研究成果,得出最终诊断。
利益冲突 所有作者声明不存在利益冲突
志谢 中国医科大学口腔医学院·附属口腔医院周怡君博士研究生协助数据采集及文章修改
作者贡献声明 史册:文章撰写与修改、数据分析及解释、对文章的知识性内容作批评性审阅;李志民:数据采集;孙宏晨:对文章的知识性内容作批评性审阅、指导研究及撰写
(参考文献略)

史册 副主任医师、博士研究生导师。中华口腔医学会口腔病理学专业委员会常务委员兼学术秘书;国际牙医学院(ICD)Fellow。曾以访问学者身份赴美国密西根大学牙学院进行合作研究2年余。主要从事牙和骨发育生物学与再生医学研究。主持国家自然科学基金项目3项(面上项目2项、青年项目1项)、中国博士后科学基金2项(特别资助1项、面上资助1项)、省级项目5项等。入选吉林大学优秀青年培养计划、吉林大学“励新优秀青年教师培养计划”(精英培养阶段)。共发表SCI收录论文26篇,其中第一作者及通信作者12篇。主讲《口腔组织病理学》,参与《口腔组织病理学》国家级精品课程和国家精品资源共享课的建设;主持吉林大学本科“创新示范课程”建设项目和吉林大学口腔组织病理学“课程思政”示范项目。

李志民 教授、主任医师、硕士研究生导师。北京大学口腔医学院放射科博士后,美国路易斯维尔大学牙学院放射科国家公派访问学者。担任中华口腔医学会口腔颌面放射专业委员会常务委员,辽宁省口腔医学会口腔颌面放射专业委员会主任委员,中华口腔医学会口腔生物学专业委员会委员。原吉林大学口腔医院口腔颌面影像诊断学教研室主任、医学影像科主任,现任中国医科大学附属口腔医院口腔颌面影像诊断学教研室副主任(主持工作)、医学影像科副主任(主持工作)。主持辽宁省科技厅项目1项、吉林省科技厅国际合作项目1项、教育厅项目1项,作为课题骨干参加国家重点研发计划专项1项,发表科研论文20余篇。人民卫生出版社出版的规培教材《口腔医学——口腔颌面影像科分册》编委。

孙宏晨 教授、主任医师、博士研究生导师,国家万人计划领军人才。原中国医科大学附属口腔医院院长,现任吉林大学口腔医院党委书记,兼任中华口腔医学会口腔病理学专业委员会主任委员。主要从事口腔颌面部疾病的病理诊断以及牙骨发育生物学与再生医学等研究。作为首席科学家和负责人,主持国家重点研发专项1项和国家自然科学基金项目9项(包括3项国家自然科学基金重点和重点国际合作项目)。发表SCI收录论文130余篇,H因子为44。获国家发明专利授权10项。主讲《口腔组织病理学》国家精品课程、精品资源共享课和国家级金课,副主编教材2部。先后被遴选为唐敖庆卓越教授、卫生部优秀青年科技人才、教育部骨干教师、宝钢优秀教师、长白山学者和兴辽人才攀登学者。




小提示:87%用户已下载掌上医讯App,更方便阅读和交流,请扫描二维码直接下载App

(本网站所有内容,凡注明来源为“掌上医讯”,版权均归掌上医讯所有,欢迎转载,转载请注明出处,否则将追究法律责任。凡是本网站注明来源为其他媒体的内容为转载,版权归原作者所有,转载仅作分享,文章观点不作为掌上医讯观点,如有侵权,请及时联系我们,联系电话:0532-67773733)

