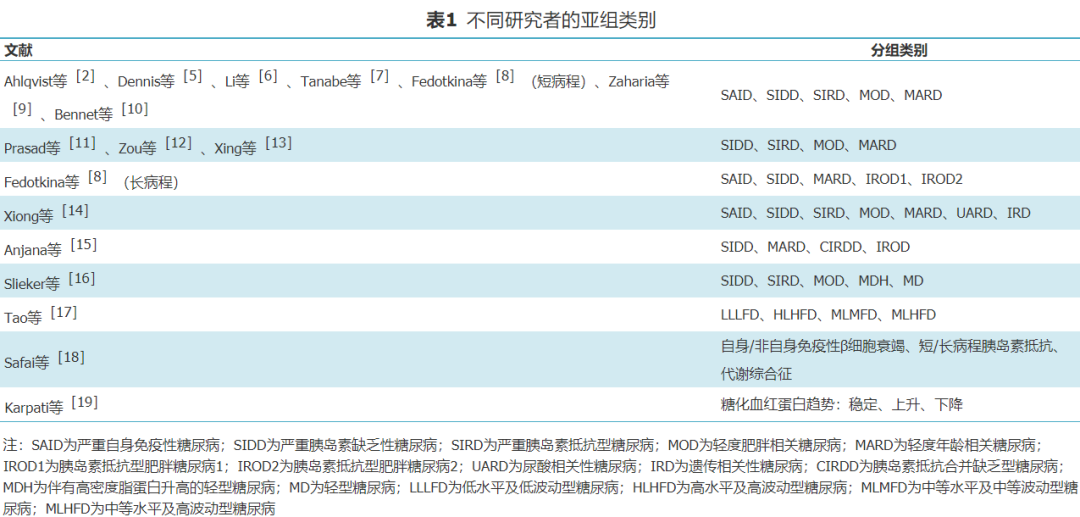
1.糖尿病聚类分型方法的提出:聚类分析是一种根据不同数据源间的相似性,将其分类到不同簇中的有效分类方法。2018年Ahlqvist等[2]使用年龄、体重指数(body mass index,BMI)、糖化血红蛋白、稳态模型2评估胰岛素抵抗指数(homeostasis model assessment-2 insulin resistance,HOMA2-IR)、稳态模型2评估β细胞功能指数(homeostasis model assessment-2 beta-cell function,HOMA2-β)、谷氨酸脱羧酶抗体(glutamic acid decarboxylase antibody,GADA)对新诊断糖尿病患者进行聚类,将其分为5组(表1,2)。其中严重自身免疫型(severe autoimmune diabetes,SAID)以GADA阳性为主要特征,且发病年龄较小,胰岛功能较差;严重胰岛素缺乏型(severe insulin-deficientdiabetes,SIDD)GADA阴性,其他特征与SAID组类似,并发视网膜病变的风险最高;严重胰岛素抵抗型(severe insulin-resistant diabetes,SIRD)HOMA2-IR最高,BMI较高,并发非酒精性脂肪性肝病、慢性肾病的风险最高;轻度肥胖相关型(mild obesity-related diabetes,MOD)BMI最高;轻度年龄相关型(mild age-related diabetes,MARD)诊断年龄最大。MOD组、MARD组代谢控制较好。SAID、SIDD组代谢控制最差。
2.糖尿病聚类分型方法的验证与补充:多名学者纷纷对此研究进行了验证与补充[5, 6, 7, 8, 9, 10, 11, 12, 13](表1,2)。中国大型研究发现,SIDD、SIRD、MARD组10年内发生心血管疾病的风险较高[6]。日本人群中SIRD组发生肾病的风险较高,SAID组视网膜病变的风险较高[7]。印度队列研究发现,SIDD组最易并发肾病和视网膜病变,而神经病变在MOD组更常见[11]。德国研究发现,SIRD组非酒精性脂肪性肝病患病率最高,SIDD组最易并发神经病变[9]。
此外,Fedotkina等[8]还对乌克兰人群中病程较长的患者进行了聚类,发现SAID组的例数是新诊断患者的2倍。以胰岛素抵抗合并肥胖为特征的人群很难与短病程中的SIRD或MOD组相匹配,故将其分为2类:1类HOMA2-IR较高、HOMA2-β较低;2类BMI及HOMA2-IR均较高,且HOMA2-β显著升高。1类患者易并发肾脏病变,2类患者微血管并发症最少见,尤其是慢性肾脏病和神经病变。5年随访研究发现,SIDD组在基线时空腹血糖水平较高,5年后下降,与其他组的变化相反[9]。以上结果提示随着病程的延长,聚类分组及特征可能会发生改变。
除病程外,加入其他不同的聚类变量也会产生不同的结果。基于中国人群的特点,将甘油三酯和尿酸加入聚类变量后,得到了尿酸相关性糖尿病和遗传相关性糖尿病[14]。前组HOMA2-IR较低、β细胞功能较好,年龄较大,患冠心病及终末期肾病的风险较高。后组多有糖尿病家族史、BMI较低、代谢控制相对较好。Anjana等[15]使用多个变量聚类后得到了4组:SIDD、MARD、胰岛素抵抗合并肥胖组和胰岛素抵抗伴缺乏组。胰岛素抵抗伴缺乏组发病年龄较低且代谢控制差,较易并发肾病。SIDD组视网膜病变的风险最高。将高密度脂蛋白胆固醇纳入聚类变量后也可得到两个独特的分组:没有极端特征的轻型糖尿病组和病情进展较慢的伴高密度脂蛋白胆固醇升高的轻型糖尿病组[16]。伴有高密度脂蛋白胆固醇升高的轻型糖尿病组血糖恶化的风险很低。
3.糖尿病聚类分型下各亚组并发症风险的差异:糖尿病常引起眼、肾、神经、心血管等组织的慢性进行性病变,给社会和家庭带来了巨大的经济压力,同时也是患者死亡的重要原因。针对各亚组并发症风险进行早期预防,可以延长患者的生存时间,减轻社会压力。
糖尿病视网膜病变是最常见的微血管并发症,是糖尿病人群视力障碍和失明的主要原因。SIDD组视网膜病变的发生率最高,表明胰岛素缺乏引起的高血糖在微血管并发症中具有关键作用。此外,胰岛素抵抗合并缺乏型[15]、SAID[7, 8]、MOD组[13]也显示了较高的风险。
糖尿病周围神经病变是致残的重要原因。不同队列中SIDD组和SIRD组患病率均较高。部分研究表明MOD组的患病率最低[8,13],这与Prasad等[11]的研究结果相反,可能与后者纳入的研究对象为印度年轻人群有关,此类人群较易出现胰岛素缺乏。
糖尿病肾脏病是导致肾衰竭及终末期肾病的常见原因。多项研究[2,7,13, 14]发现SIRD组风险最高,提示胰岛素抵抗在糖尿病肾病的发生和早期进展中具有重要的作用。印度年轻人群中SIDD组患病风险最高[11]。中国人群中尿酸相关性糖尿病组患终末期肾病的风险也较高[14]。
糖尿病患者发生心脑血管疾病风险增加2~4倍[21]。心脑血管疾病在糖尿病各亚组中的发生风险仍存在争议性。有学者发现SIDD组心血管死亡的风险最高,MOD组心力衰竭的风险最高[7, 8,22]。中国人群中SIDD、SIRD、MARD组10年内发生心血管疾病的风险较高[12],尿酸相关性糖尿病组的风险也较高[14]。德国队列中,SIRD组风险较高,SAID组较低[23]。而瑞典原始研究中冠状动脉疾病、卒中的风险在组间无差异[2]。Safai等[18]认为是否合并脑血管疾病是由年龄和糖尿病持续时间等因素来决定的,而不是分组所决定的。
SIRD组显著的脂肪肝发生风险也被纷纷证实。SIRD组脂质水平控制较差,更易导致脂肪肝[13, 14, 15]。随访研究发现,SIRD组基线时肝细胞脂质含量最高,5年后肝纤维化更为普遍;SAID组在基线时有更稳定的血脂水平,5年后肝细胞脂质含量最低[9]。Herder等[24]发现SIRD组的炎症生物标志物水平最高,炎症生物标志物外溢进入循环已被认为是可能启动异常肝糖代谢和2型糖尿病的重要机制[25]。