【综述】肌少性肥胖与2型糖尿病关系的研究进展
文章来源:中华内分泌代谢杂志, 2023,39(1) : 66-71
作者:曾菲晖 刘礼斌
肌少性肥胖与糖尿病是两种世界范围内严重影响老龄人口健康和生活质量的慢性非传染性疾病。2020年中国居民营养与慢性病状况报告显示,全国成人超重率为34.3%,肥胖率为16.4%,均呈上升趋势。由于久坐不动等不良生活方式、脂肪组织紊乱、共病以及衰老过程中的代谢变化,骨骼肌质量和功能丧失即肌少症在肥胖个体中很常见[1]。Baumgartner等[2]于2000年首次提出肌少性肥胖的概念。2021年一项纳入了50项研究的meta分析表明,肌少性肥胖影响全球十分之一以上的老年人。而与单纯肥胖或肌少症患者相比,老龄肌少性肥胖人群遭遇不良临床结局的概率显著增高[3]。
我国成人糖尿病患者数量已高达1.096亿,居全球首位[4]。胰岛细胞功能异常与胰岛素抵抗是2型糖尿病的主要发病机制,其中,胰岛素抵抗在肌少性肥胖发病机制中同样起着重要作用;另一方面,肌少性肥胖患病人群的主要特点衰老与肥胖是糖尿病的重要危险因素[5,6]。因此,肌少性肥胖与2型糖尿病的患病人群及危险因素有一定重叠,且二者的发病机制可能存在密切联系,故本文综述了国内外关于二者的研究进展。
一、肌少性肥胖的诊断标准与流行病学
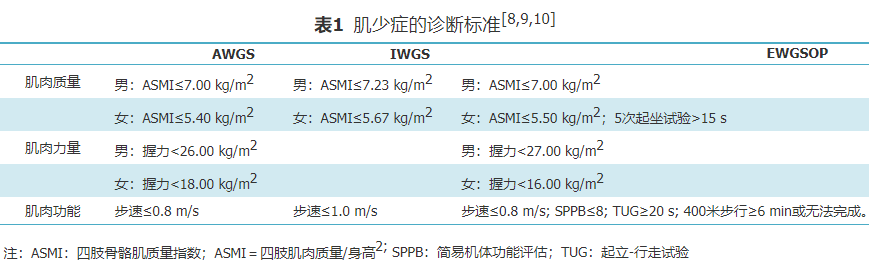
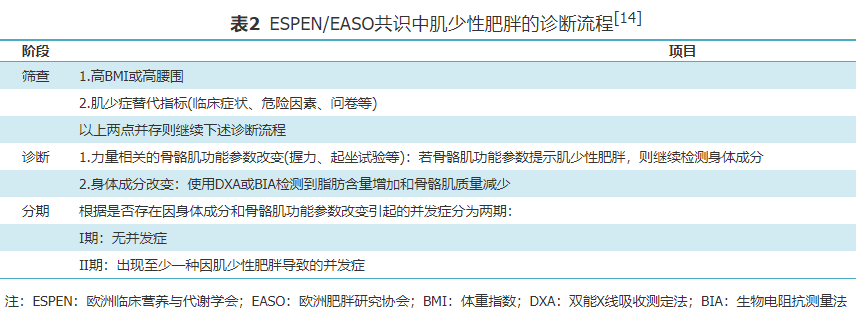
肌少性肥胖症被定义为肥胖症和肌少症的共存,目前暂无统一的诊断标准[7]。关于肌少症的诊断标准,以国际肌少症工作组(The International Working Group on Sarcopenia, IWGS)、欧洲肌少症工作组(The European Working Group for the Study of Sarcopenia, EWGSOP)及亚洲肌少症工作组(Asian Working Group for Sarcopenia, AWGS)的标准应用最为广泛(表1)。尽管肌肉减少症的评估方法有所差异,但肌肉质量、肌肉力量及肌肉功能是主要的评估指标。其中,肌肉质量以双能X线吸收测定法(Dual-energy X-ray absorptiometry, DXA)、生物电阻抗测量法(bioelectrical impedance analysis, BIA)为主要检测手段,肌肉力量以握力为主要评判指标,肌肉功能则包括步速、简易机体功能评估(short physical performance battery, SPBB)、起立-行走试验(timed up and go test, TUG)及400 m步行等内容。 与肌少症类似,肥胖同样没有统一的诊断标准[7],以世界卫生组织(WHO)的标准最为常用,规定男性体脂率>25%或体重指数(BMI)≥30 kg/m2或腰围≥102 cm、女性体脂率>35%或BMI≥30 kg/m2或腰围≥88 cm即为肥胖。综上,整合肥胖与肌少症的诊断标准即可诊断肌少性肥胖。 由于诊断标准的不一致以及研究人群的差异性,各文献报道的肌少性肥胖患病率存在较大差异。2013年,Batsis等[11]对同一人群应用不同肌少性肥胖诊断标准,观察到不同标准所对应的患病率差异巨大,可相差26倍之多。国内关于肌少性肥胖的研究,诊断标准各异,多以BIA为主要检测手段,患病率同样存在较大差异。一项纳入50项研究的meta分析显示,老年人肌少性肥胖的全球患病率为11%,该研究发现,不同的肌少症诊断标准、肌肉质量评估方法以及地理区域和研究环境是患病率异质性的主要来源,当单独使用肌肉质量诊断肌少症时,肌少性肥胖的患病率约为15%,而当使用肌肉质量与肌肉力量指标共同评估患者时,肌少性肥胖的患病率约为4%;然而并未观察到在不同的肥胖诊断标准和性别之间的患病率有显著差异[12]。 2019年AWGS发布的肌少症诊治共识更新中显示,考虑到亚洲有关肌少性肥胖、肌少性骨质疏松等概念的证据有限,决定不遵循最近的趋势,仍保留肌少症最初的定义,暂未推荐肌少性肥胖特定的诊断标准或治疗方法[13]。为了寻找合适和充分的肌少性肥胖的定义以及诊断标准,2022年欧洲临床营养与代谢学会(the European Society for Clinical Nutrition and Metabolism, ESPEN)和欧洲肥胖研究协会(the European Association for the Study of Obesity, EASO)就肌少性肥胖的定义和诊断标准达成新共识,将疑似肌少性肥胖个体的诊断流程分为筛查、诊断、分期3个阶段(表2)[14]。对于疑似个体主要通过BMI或腰围以及肌少症的临床症状和危险因素进行筛查;筛查后对可疑患者重点评估骨骼肌功能参数和身体成分以明确诊断;在诊断成立后根据有无因身体成分和骨骼肌功能下降引起的并发症进行分期。尽管该共识并非结论性的报告,但可以将其视为一个良好的起点,也是朝着定义和诊断方向迈出的重要一步。2022年日本学者Shimizu等[15]进行了一项单中心回顾性研究,将ESPEN和EASO新标准应用于1 080名65岁的老年人群,得出肌少性肥胖的患病率约为4%。
二、肌少性肥胖的危害
骨骼肌质量和功能的丧失往往随年龄的增长而发生,且通常伴随着身体脂肪增加,这一过程有利于肌少性肥胖的潜在发生和发展。然而,任何年龄的肥胖个体都可能出现肌少症[1]。已有大量研究表明,肌少性肥胖比单独的肌少症或肥胖能增加更多的负面影响。近年来,肌少性肥胖更是一直被证明是各种常见病条件下虚弱、共病和死亡率的一个强而独立的危险因素,也被认为是一般人群,尤其是老年人群全因死亡率的一个独立预测指标[16]。包括心脏代谢综合征、糖尿病、心血管疾病(cardiovascular disease, CVD)和癌症在内的代谢紊乱均为肌少性肥胖的常见合并症[17,18]。一项包含606篇文章的meta分析表明,与仅有超重或肥胖的个体相比,肌少性肥胖使2型糖尿病的风险增加了近38%[17]。
肌少性肥胖的另一个重要后果是残疾风险高于健康人群。肌少性肥胖会增加跌倒和骨折的风险,从而导致行动不便[19]。与肌肉量正常和腰围正常的人相比,肌肉量减少的肥胖患者更容易患膝关节骨关节炎和抑郁症,心理健康状况更差[20]。在财务方面,肌肉减少症的存在会增加住院风险和住院费用。
三、肌少性肥胖与2型糖尿病的相互关系
1.肌少性肥胖在2型糖尿病人群中的患病率: 2型糖尿病是发生肌少性肥胖的重要危险因素。目前为止,鲜少研究报道糖尿病患者中肌少性肥胖的患病率,已有研究显示的发病率亦各不相同。Serena等[21]的研究显示发现,新加坡亚洲人群中2型糖尿病患者的肌少性肥胖患病率将近20%。然而有关2型糖尿病患者中肌少性肥胖的筛查和预测研究较少。在2022年ESPEN和EASO共识声明中推荐,对肌少性肥胖的筛查可基于BMI或腰围的升高,以及肌少症的替代指标,例如临床症状、危险因素和包括SARC-F在内的有效问卷。韩国一项研究显示,在新诊断的、未接受过药物治疗的2型糖尿病患者中,低肌肉质量合并腹部肥胖的受试者比例为8.2%[22]。在韩国一项使用膳食营养素模式预测研究中表明,单位体重的总卡路里摄入量和碳水化合物摄入量与肌少性肥胖呈反比,其中碳水化合物摄入量对肌少性肥胖的可预测性最高[23]。有研究显示握力与BMI的比率可预测儿童是否存在肌肉减少性肥胖[24],但尚未有大样本研究提出预测肌少性肥胖的合适指标。
2.肌少性肥胖对2型糖尿病并发症的影响: 糖尿病并发症分为急性与慢性并发症。其中,慢性并发症包括微血管病变、大血管病变以及神经病变等,累及心、脑、肾等重要脏器,是治疗的重点与难点。肌少性肥胖与糖尿病在发病机制上存在相互关联性,但目前关于肌少性肥胖对糖尿病慢性并发症影响的研究仍然较少。日本一项研究表明,肌少性肥胖与2型糖尿病患者肾功能下降有关[25]。即使调整了HbA1C、糖尿病视网膜病变、是否使用血管紧张素受体阻滞剂、血管紧张素转换酶抑制剂和钙通道阻滞剂等混杂因素,肌少性肥胖仍与估算的肾小球滤过率(eGFR)年下降率密切相关。除此之外,Takahashi等[26]的研究纳入了369例2型糖尿病患者,发现其中合并肌少性肥胖者尿白蛋白排泄率较无肌少症也无肥胖者、单纯肥胖者、单纯肌少症者显著升高,同样证明了肌少性肥胖对2型糖尿病患者肾功能的负面影响。另有研究表明肌少性肥胖与糖尿病心血管并发症有关。Fukuda等[27]进行了一项纳入716例2型糖尿病患者、平均随访时间2.6年的回顾性研究,以DXA为诊断方法,发现肌少性肥胖是2型糖尿病患者发生卒中、不稳定心绞痛、心肌梗死等心血管并发症的独立危险因素。国内也有研究表明肌少性肥胖增加了2型糖尿病患者左室重构与左室舒张功能障碍风险[28]。认知功能障碍与2型糖尿病患者脑血管并发症及血糖控制不佳有关,严重影响患者的自我管理能力与生活质量[29]。新加坡学者发现,肌少性肥胖与2型糖尿病患者认知能力下降有独立相关性,尤其影响了患者在语言与记忆方面的表现[21]。慢性并发症是影响糖尿病患者寿命和生活质量的主要原因,以上研究结果表明,肌少性肥胖增加2型糖尿病并发症发生风险,然而需要更多的研究来揭示肌少性肥胖对糖尿病并发症的作用机制与影响。
3.肌少性肥胖与2型糖尿病相互作用机制:
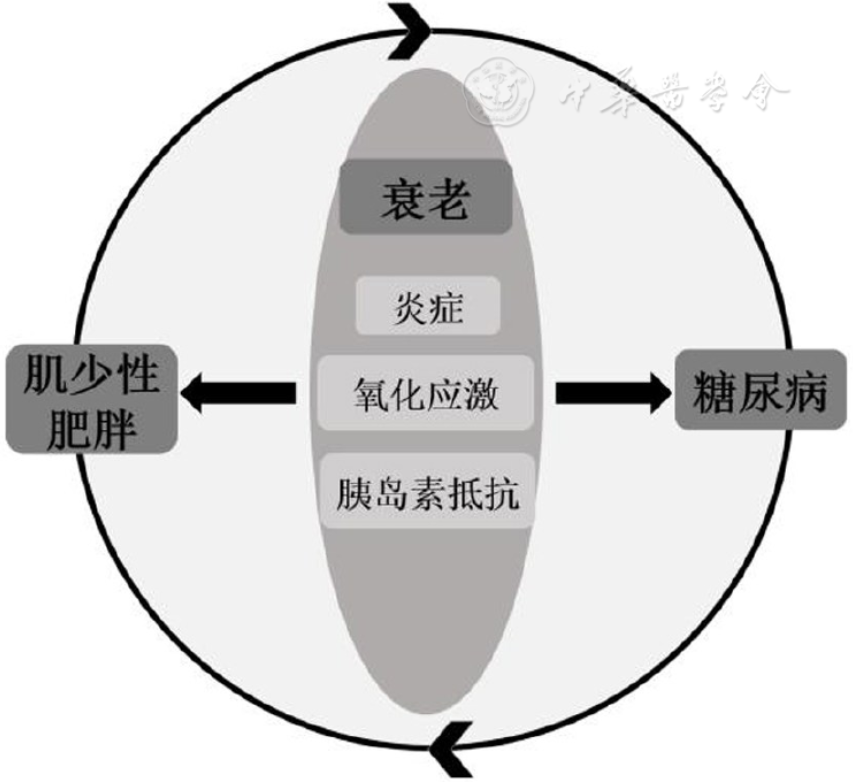
肌少性肥胖与糖尿病的相互作用机制尚未完全明确。衰老的过程伴随着体成分与激素分泌的改变、慢性病的发生以及生活习惯如饮食与运动方式的改变,多种因素共同导致老龄人群体内易存在慢性炎症、氧化应激甚至胰岛素抵抗等状态,而这些状态是肌少性肥胖与2型糖尿病的共同发病机制,导致这2种疾病在老龄人群内相对高发[7]。肌少性肥胖与2型糖尿病二者之间又存在着复杂的相互关系。一方面,2型糖尿病患者存在胰岛素抵抗所导致的高胰岛素血症,促进脂肪的合成,抑制了脂肪的分解;而体内脂肪量的增加会促进各种细胞因子的分泌,加速肌肉的分解代谢,导致肌少症。另一方面,肌少性肥胖患者肌肉量的减少将导致靶组织对胰岛素的反应减弱,从而加重胰岛素抵抗,形成持续的恶性循环,导致不良临床结局(图1)。
图1 肌少性肥胖与糖尿病之间的恶性循环
四、肌少性肥胖合并糖尿病患者的综合管理
对于肌少性肥胖合并糖尿病的老龄患者,运动疗法与饮食管理是首要的干预手段。药物治疗是控制糖尿病的主要方法之一,但目前暂无对于肌少性肥胖公认的治疗药物。
1.饮食管理: 限制热量摄入、补充蛋白质与微量营养素是主要的饮食干预措施。控制热量摄入有助于肥胖与超重人群减重,而减重对控制2型糖尿病有着重要作用[30]。减重目标应控制在初始体重的5%~8%为宜[31]。由于短期快速减重可能加速蛋白质水解,对于肌肉蛋白质合成有着负面影响,因此渐进式减重更被推荐[32]。足量的蛋白质摄入对于维持骨骼肌质量有着重要作用。对于老年人,推荐的蛋白质日摄入量为1.2~1.6 g·kg-1·d-1[33]。Houston等[34]对2 066名70~79岁的老年人进行3年随访,发现蛋白质摄入较低人群(0.8±0.3 g·kg-1·d-1)较摄入较高人群(1.2±0.4 g·kg-1·d-1)肌肉质量下降增加40%。另外,有研究表明摄入的蛋白质来源可能与2型糖尿病发病风险有关。Shang等[35]发现研究人群中动物蛋白摄入量最高分位组罹患2型糖尿病的风险较最低组显著上升[RR=1.19(95%CI 1.11~1.28)];而植物蛋白摄入量最高分位组的人群发生2型糖尿病的风险降低,但结果并无统计学意义。伊朗一项研究表明,以豆类摄入代替红肉的饮食干预有助于糖尿病患者的血脂与血糖控制[36]。尽管有研究表明植物蛋白对于肌肉合成代谢的刺激作用弱于动物蛋白,但可通过选择性育种与添加氨基酸等方式改善植物蛋白的品质[37]。有证据表明,坚持得舒饮食(dietary approaches to stop hypertension, DASH)对降低肌少性肥胖的风险具有显著影响,DASH饮食提倡选择以下食物:饱和脂肪和反式脂肪含量低,富含微量元素、纤维素和蛋白质,以及钠含量较低[38]。 维生素D在人体内主要参与钙代谢的调节。尽管目前暂无肌少性肥胖患者应用维生素D补剂的相关临床研究结果,但维生素D对于老年人群的重要性已得到广泛认可,其缺乏与肌肉力量下降、步态失稳、摔倒与残疾的风险增加有关[39]。另有一项研究证实维生素D的活性形式25-羟基维生素D3(25-OHD3)可通过作用于体内脂肪组织来间接影响肌肉功能[40]。因此,增加肌少性肥胖患者饮食中维生素D的摄入量有利于降低减重的负面影响。Omega-3是一组多不饱和脂肪酸,既可通过促进肌肉蛋白纤维合成直接影响肌肉质量,又可抑制体内低度炎症[41,42]。这样的特性使得Omega-3适用于肌少性肥胖合并糖尿病人群,但目前仍缺乏明确的临床证据,需要更多研究来确定最合适的Omega-3类型以及剂量。
2.运动疗法: 注意饮食的同时结合运动是针对肌少性肥胖合并糖尿病患者最有效的治疗方案。合理的运动方式对人体有诸多积极意义:降低系统性炎症、促进肌卫星细胞的增殖分化、提高胰岛素敏感性、刺激线粒体生物发生等[43,44]。对于肌少性肥胖患者,抗阻训练能够有效避免由于节食减重导致的肌肉流失,其与有氧运动的组合被认为是最适合的运动方式。Colleluori等[45]的研究表明有氧结合抗阻力运动在改善肌肉蛋白合成和提高肌细胞质量方面比单纯有氧或抗阻力运动更为有效。一项临床研究同样证实了复合运动疗法对于肥胖老龄人群的积极影响:同时行有氧与抗阻训练者在6个月后获得了较高的体能测试评分[46]。Zhuan等[47]进行了一项meta分析以评估有氧运动、抗阻训练及二者结合的运动模式对于老龄肌少性肥胖的改善作用,发现有氧运动可有效帮助患者控制体重及BMI,抗阻训练可改善患者四肢骨骼肌质量、握力及伸膝力量等指标,而二者结合则有助于在降低BMI与体脂率的同时提高四肢骨骼肌质量与步速。另一方面,适当运动可改善β细胞的功能,不仅能够降低2型糖尿病的发病风险,还可以在一定程度上缓解2型糖尿病。美国糖尿病预防计划(US Diabetes Prevention Program)推行了一种强调合理饮食与运动的生活方式,即通过控制饮食减重7%且每周进行至少150 min中等强度的运动,发现在3 234名志愿者中生活方式改变者糖尿病发病率较安慰剂组下降58%,效果甚至较二甲双胍更佳[48]。糖尿病患者健康行动(LOOK AHEAD: Action for Health in Diabetes)将受试者随机分为生活方式干预组(控制每日摄入总热量1 200~1 800 kcal、每周至少运动175 min)以及常规治疗组,2组受试者均继续原有糖尿病药物治疗,结果表明11.5%的生活方式干预参与者在第一年内2型糖尿病部分或完全缓解,7%在4年后部分或完全缓解,而这些比率高达常规治疗组的3到6倍[49]。另外,该项目的近期研究成果表明生活方式干预能够帮助2型糖尿病患者获得更好的下肢功能[50]。
3.药物治疗: 目前暂无公认的治疗肌少性肥胖的药物。研究中常用于改善肌少症的药物有雄激素、雄激素受体调节剂(selective androgen receptor modulators,SARMs)、肌生成抑制素拮抗剂(myostatin antagonist)等。睾酮可调节骨骼肌合成代谢,但可能增加女性患者男性化、男性患者前列腺增生与肿瘤风险。De Spiegeleer等[51]在对多项系统综述与meta分析进行总结后,推荐血清睾酮水平较低、有临床肌力减退症状的老年男性使用睾酮,且使用6个月无效后,就应当停药。SARMs具有组织特异性,可通过口服给药,不良反应较睾酮少[52]。肌生成抑制素是肌肉生长的负性调控因子,与肌肉生长和分化相关,在动物模型中特异性敲除该基因后,肌肉质量可显著提高[53]。在一项随机对照临床研究中,肌生成抑制素拮抗剂LY2495655被应用于老年跌倒者的治疗中,成功提高了四肢肌肉质量与肌肉功能表现[54]。但作为一类新药,其安全性及有效性有待进一步验证。 降糖药是防控糖尿病的主要手段之一,但大多数降糖药对于肌少性肥胖的作用仍然未知。二甲双胍是2型糖尿病患者控制高血糖的一线用药和药物联合中的基本用药,《中国2型糖尿病防治指南(2020版)》指出,如无禁忌证,二甲双胍应一直保留在治疗方案中[55]。已有部分研究证明二甲双胍对于肌肉组织的保护作用,如促进肌肉卫星细胞增殖、减少骨骼肌脂质积聚、抑制骨骼肌细胞炎症等[56,57,58]。但目前暂无将二甲双胍应用于肌少性肥胖的相关临床研究。胰岛素可以刺激年轻人体内的肌肉蛋白合成,但由于衰老过程中肌肉组织的胰岛素抵抗,无法预防骨骼肌萎缩[59]。另有极少数关于磺脲类药物导致肌肉萎缩的报告,但同样缺少高质量临床证据[60]。新型降糖药胰升糖素样肽1受体激动剂(glucagon-like peptide-1 receptor agonists, GLP-1RA)和钠-葡萄糖共转运蛋白2抑制剂(sodium glucose co-transport 2 inhibitors, SGLT2i)的降糖机制均与肌肉质量和体脂量变化有关,多数研究表明二者所致的体成分变化主要是脂肪量的减少,而对瘦组织无显著影响或影响相对较小[61]。但也有证据显示这两类药物显示出肌肉质量的减少,尚不清楚肌少症的风险是否会因此而增加。利拉鲁肽系列研究(Liraglutide Effect and Action in Diabetes, LEAD)结果显示,2型糖尿病患者使用利拉鲁肽早期的体重减轻主要由脂肪量减少构成,而加大剂量后则以肌肉质量减少为主[62]。在Cefalu等[63]的一项为期52周的随机对照试验中,卡格列净在降低脂肪量的同时,肌肉质量也有很大程度的降低。
五、总结
人口老龄化趋势使得肌少性肥胖合并糖尿病患者数量日渐增多。目前对于肌少性肥胖尚缺乏统一的诊断标准,不同研究对肌少性肥胖的患病率报道不一。肌少性肥胖与糖尿病在发病机制上存在双向作用,易形成恶性循环,目前虽有多种假说,但具体机制不明,期待未来开展更多基于新共识的研究,揭示二者的内在联系,为肌少性肥胖合并糖尿病的早期识别和治疗提供相应的可靠依据。生活方式干预包括饮食管理与运动疗法是预防和治疗肌少性肥胖的有效手段,药物治疗对肌肉质量和肌肉力量的综合影响需要进一步探索。在应用降糖药物时,应注意降糖药物对肌肉质量的影响。
参考文献 (略)
扫码下载杂志官方App


小提示:87%用户已下载掌上医讯App,更方便阅读和交流,请扫描二维码直接下载App

(本网站所有内容,凡注明来源为“掌上医讯”,版权均归掌上医讯所有,欢迎转载,转载请注明出处,否则将追究法律责任。凡是本网站注明来源为其他媒体的内容为转载,版权归原作者所有,转载仅作分享,文章观点不作为掌上医讯观点,如有侵权,请及时联系我们,联系电话:0532-67773733)